Impulscontrolestoornissen bij de ziekte van Parkinson
11 juli 2018
Impulscontrolestoornissen kunnen beschouwd worden als de meest gevreesde bijwerking van dopaminerge suppletie bij patiënten met de ziekte van Parkinson (ZvP). Impulscontrolestoornissen kunnen beschreven worden als een gedragsverslaving, waarbij mensen niet meer in staat zijn om bepaalde gedragingen te onderdrukken. Hierbij kan gedacht worden aan gokken, seks, eten of spullen kopen.
Geplaatst op 19 mei 2017
De emotionele, sociaal-maatschappelijke en/of financiële schade van dit soort gedragingen is vaak groot. Vijftien tot 35% van de patiënten met de ZvP ontwikkelt een impulscontrolestoornis na het starten van dopaminerge medicatie; medicatie die noodzakelijk is om onder andere de motorische klachten van de ziekte te bestrijden. Onbekend is nog waarom sommige patiënten wel en anderen niet een impulscontrolestoornis ontwikkelen. Een betere risico inschatting voorafgaand aan de start van de medicatie zou veel leed kunnen besparen. Gebruik van o.a. een DaT SPECT hersenscan, om een indruk van de hoeveelheid schade aan het dopamine systeem te krijgen, zou hierbij een rol kunnen spelen.
Op basis van literatuuronderzoek (Vriend et al. 2014b2) bestaat de hypothese dat schade aan het dopamine systeem in een gebied van de hersenen dat belangrijk is voor motivatie en beloning (het ventraal striatum) kan leiden tot ontregeling van het beloningssysteem wat het risico op het ontwikkelen van impulscontrolestoornissen verhoogt. Om bewijs te leveren voor deze hypothese hadden wij reeds een kleine studie in 32 parkinsonpatiënten met behulp van DaT SPECT hersenscans uitgevoerd (Vriend et al. 2014c3). De resultaten van dit onderzoek bevestigden onze hypothese: patiënten die na het starten van dopaminerge medicatie symptomen van impulscontrolestoornissen ontwikkelden, lieten op de DaT SPECT hersenscan meer verlies van dopamine zien in het ventraal striatum ten opzichte van patiënten die geen symptomen van impulscontrolestoornissen ontwikkelden. Deze hersenscan zou dus een voorspellende waarde kunnen hebben bij het inschatten van het risico op impulscontrolestoornissen. Om dit te bewijzen was echter een grotere en beter gecontroleerde studie nodig. Met financiële ondersteuning van de Parkinson Vereniging zijn we deze studie gestart. Onze verwachting was in eerste instantie om in twee jaar tijd 60 parkinsonpatiënten te includeren en om deze gedurende vier jaar te volgen om het mogelijke ontstaan van impulscontrolestoornissen na het starten van medicatie te monitoren. Tot op heden is dit doel echter nog niet bereikt. Dit komt met name doordat de te includeren patiënten aan een veelheid aan criteria moeten voldoen (o.a. beschikbaarheid van DaT SPECT hersenscan, afwezigheid van gebruik antidepressiva, en nog niet gestart met dopaminerge medicatie). Gezien het feit dat een DaT SPECT alleen binnen VU medisch centrum ‘standaard’ wordt afgenomen, is de inclusie van patiënten beperkt tot de eigen instelling. Op dit moment doen er in totaal 22 patiënten mee aan deze studie. In samenspraak met de Parkinson Vereniging is besloten deze studie desondanks voort te zetten zonder verdere financiële ondersteuning.
Mensen die kampen met een impulscontrolestoornis hebben moeite om gedrag te inhiberen. Om dit te kunnen meten zijn zogenaamde respons-inhibitietaken ontwikkelt. Het uitvoeren van een respons-inhibitietaak, terwijl er hersenscans worden vervaardigd, kan inzicht bieden in het neurobiologisch proces van verstoorde impulscontrole. In een tweede studie hebben wij 21 Parkinsonpatiënten en 37 gezonde vrijwilligers gevraagd een responsinhibitie-taak (de stop taak) uit te voeren terwijl er MRI scans werden vervaardigd om de hersenactiviteit te meten. Deze patiënten met de ZvP waren recent gediagnosticeerd, waren vrij van psychiatrische aandoeningen – waaronder impulscontrolestoornissen – en gebruikten (nog) geen dopaminerge medicatie. Deze studieopzet stelden ons in staat om specifiek naar de effecten van de ziekte op (eventuele) verstoring van impulscontrole te kijken, zonder belemmering van mogelijke effecten van medicatie en neurobiologische veranderingen door de ontwikkeling van psychiatrische klachten. Eerdere studies waarin parkinsonpatiënten al wel dopaminerge medicatie gebruikten lieten over het algemeen een verminderde impulscontrole zien in patiënten met Parkinson ten opzichte van gezonde controle, zelfs zonder dat er sprake was van een klinisch significante impulscontrolestoornis. In onze studie waren parkinsonpatiënten trager in het starten van een respons maar slechts marginaal trager in het remmen (inhibitie) van responsen in vergelijking met de gezonde controleparticipanten. Patiënten lieten echter wel een verminderde hersenactiviteit zien in de linker en rechter inferieure frontale gyrus en inferieure pariëtale gyrus, gebieden waarvan bekend is dat zij belangrijk zijn voor responsinhibitie. Daarnaast was de activiteit in de inferieure frontale gyrus gecorreleerd aan de ziekte-ernst, waarbij ernstiger aangedane patiënten een lagere activiteit vertoonden dan minder aangedane patiënten. Deze resultaten laten zien dat, hoewel patiënten met Parkinson vóór het starten van dopaminerge medicatie nog vrij goed in staat zijn hun gedrag te onderdrukken, ze wel veranderingen in hersenactiviteit laten zien. Deze veranderingen vormen mogelijk een neurobiologisch substraat voor de ontwikkeling van impulscontrolestoornissen na starten van medicatie (Vriend et al. 20154).
Na gemiddeld 3 jaar is een deel van de parkinsonpatiënten en gezonde controles nogmaals uitgenodigd om deel te nemen aan follow-up MRI onderzoek. Zestien parkinsonpatiënten en zestien gezonde controles gaven aan deze uitnodiging gehoor. Alle patiënten waren in de tussenliggende periode dopaminerge medicatie gaan gebruiken. Twee parkinsonpatiënten moesten worden geëxcludeerd omdat zij de taak niet goed konden uitvoeren waardoor het totaal op 14 patiënten uitkwam. Slechts twee parkinsonpatiënten hadden in de follow-up periode significante symptomen van impulscontrolestoornissen ontwikkeld waardoor een vergelijking tussen patiënten met en zonder impulscontrolestoornissen niet mogelijk was. Net als bij de baseline meting waren patiënten bij de tweede meting trager in het starten van een respons en minder goed in staat om hun respons te remmen (inhiberen). Als deze resultaten worden vergelijken met die van de eerste meting (vóór medicatie) valt op dat de patiënten over de tijd geen veranderingen in zowel het starten als het remmen van de responsen lieten zien maar dat de gezonde controles bij de tweede meting beter in staat waren om hun responsen te remmen waardoor er nu tijdens de tweede meting wel een verschil is tussen beide groepen (zie figuur 1). Dit zou mogelijk verklaard kunnen worden doordat de gezonde controles konden profiteren van het feit dat ze de taak al eens eerder hadden uitgevoerd en reeds vertrouwd waren met het uitvoeren van deze taak in de MRI scanner. Mogelijk dat de patiënten hier meer moeite mee hadden. Er was geen relatie tussen de ernst van de motorische klachten of de ernst van de symptomen van impulscontrolestoornissen en de prestaties op de taak bij de tweede meting.
Parkinsonpatiënten lieten, in tegenstelling tot de resultaten bij bovengenoemde baseline meting, geen verschillen meer zien in taak-gerelateerde hersenactiviteit ten opzichte van gezonde controles. Naast hersenactiviteit hebben we in deze analyse echter ook naar hersenconnectiviteit gekeken tijdens het uitvoeren van de taak. Met deze analyse hebben wij onderzocht of er een verschil was tussen patiënten en controles in de mate waarin hersengebieden die belangrijk zijn voor deze taak met elkaar communiceren. Hoewel ten opzichte van gezonde controles, patiënten geen verschillen lieten zien in hersenconnectiviteit tijdens het uitvoeren van de taak bij de eerste meting, tijdens de follow-up meting lieten meerdere hersengebieden verminderde hersenconnectiviteit zien (Vriend et al., under review). Deze resultaten kunnen geïnterpreteerd worden als een effect van dopaminerge medicatie op hersenactiviteit (welke bij de follow-up meting lijkt te zijn verbeterd) maar niet hersenconnectiviteit (welke achteruit lijkt te zijn gegaan). Het achteruitgaan van de hersenconnectiviteit zou mogelijk het effect kunnen zijn van de progressie van de ZvP.
Bij het interpreteren van deze resultaten moeten wel enkele beperkingen van deze studie in acht worden genomen. Omdat in de periode tussen de baseline en follow-up meting de MRI scanner is vervangen was een één-op-één vergelijking van de veranderingen in hersenactiviteit en hersenconnectiviteit helaas niet goed mogelijk. Ook was de groep patiënten en controles welke ingingen op onze uitnodiging om nogmaals een MRI meting te ondergaan relatief klein. Ter bevestiging van deze resultaten is dan ook onderzoek in een grotere groep nodig.
Internationale publicaties o.b.v. deze studies:
2 Vriend C, Pattij T, van der Werf YD, Voorn P, Booij J, Rutten S, Berendse HW, van den Heuvel OA. Depression and impulse control disorders in Parkinson’s disease: two sides of the same coin. Neuroscience and Biobehavioral Reviews, 2014;38C: 60-71
3 Vriend C, Nordbeck AH, Booij J, van der Werf YD, Pattij T, Voorn P, Raijmakers P, Foncke EMJ, van de Giessen E, Berendse HW, van den Heuvel OA. Reduced dopamine transporter binding predates impulse control disorders in Parkinson’s disease. Movement Disorders, 2014; 29: 904-11.
4 Vriend C, Gerrits NJ, Berendse HW, Veltman DJ, van den Heuvel OA*, van der Werf*. Failure of stop and go in de novo Parkinson’s disease – a functional magnetic resonance imaging study. Neurobiology of Aging, 2015; 36: 470-5.
- Vriend, Leffa, Trujillo, Gerrits, de Boer, Berendse, Van der Werf, and Van den Heuvel, Functional activity and connectivity changes in Parkinson’s disease during the stop-signal task: a follow-up study (under review). 2016, VU University medical center: Amsterdam, the Netherlands.
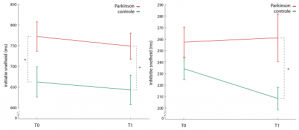
Figuur 1 – grafieken van de groepsverschillen in initiatie (links) en inhibitie (rechts) snelheid bij de meting vóór het gebruik van dopaminerge medicatie door patiënten met Parkinson (T0) en daarna (T1).
